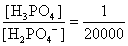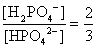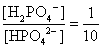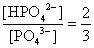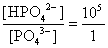生物體內的緩衝溶液
- 2021.11.04
- 作者:授課橘化學小編
- 化學
- 8667
| 學習領域/科目別 | 化學 |
|---|---|
| 情境範疇 | 水溶液中的酸、鹼、鹽平衡反應 |
題幹
血液是人體中相當重要的液體,同時也是一個十分穩定的緩衝系統,與肺臟及腎臟可以調節血液中的酸鹼值,嚴謹的控制在7.35∼7.45之間,使體內的許多生化反應可以順利進行,因此不管是酸性食物或鹼性食物,在正常人的飲食範圍內,都不會對血液的酸鹼性造成太大的影響。一旦血液酸鹼值超出正常範圍,對人體會產生相當大的影響,甚至造成生命危險。若低於範圍,稱為「酸血症」;相對的高於範圍,稱為「鹼血症」,為血液中酸鹼值失去平衡的症狀。臨床上檢驗血液中酸鹼值的原理,是利用pH計來測定血液中的酸鹼值。除了測定血液當中的酸鹼值,通常會合併測定血液當中的氧分壓(pO2)、二氧化碳分壓(pCO2)、重碳酸鹽(HCO3−)及鹼超量(base excess),進一步判讀血液當中酸鹼變化的原因。
〔參考資料〕臺大醫院健康電子報,2016年2月99期。
| 問題一 |
1.在人體血液中pH值的調節,主要是依賴血液中 參考答案 :
2. B
搭配學習內容/學習表現 :
配合章節 × 選修化學(III)▼CH2 水溶液中的酸、鹼、鹽平衡反應
試題概念與分析 :
(1)人體體溫、二氧化碳的亨利定律常數及碳酸的解離平衡常數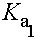 (2) 
|
|---|
延伸閱讀材料
| 文章 | 化學素養試題超展開 VOL.02 |
|---|
推薦相關文章
留言

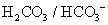 緩衝溶液系統來維持
緩衝溶液系統來維持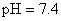 。在重碳酸緩衝系統(the bicarbonate buffer)中,考慮以下兩平衡式:
。在重碳酸緩衝系統(the bicarbonate buffer)中,考慮以下兩平衡式: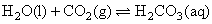 ;
;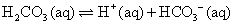 ,合併上述二式,可簡化得:
,合併上述二式,可簡化得: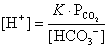 ,其中K為一常數。上述簡化式中,K值大小與哪些因素有關?
,其中K為一常數。上述簡化式中,K值大小與哪些因素有關?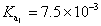 ,
,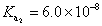 ,
,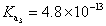 , 人體內血液系統緩衝溶液之pH值為7.40,主要由重碳酸鹽緩衝系統維持。若要配製與血液pH值相同的磷酸緩衝生理食鹽水,則組成緩衝的離子濃度比例為何?
, 人體內血液系統緩衝溶液之pH值為7.40,主要由重碳酸鹽緩衝系統維持。若要配製與血液pH值相同的磷酸緩衝生理食鹽水,則組成緩衝的離子濃度比例為何?